Technical
| Begriff | Definition |
|---|---|
| Inega | Inega 200 kg C02/m3 Beton 2400 kg = 75 kg PK/m3
Zugriffe - 1600
|
| Inkohlung H/C O/C | Je länger die Inkohlung fortschreitet, desto weniger Sauerstoff und Wasserstoff enthält die Kohle. Je nach Dauer der Inkohlung entsteht zunächst Torf, dann Braunkohle, Steinkohle und schließlich Grafit.
Zugriffe - 1525
|
| Innenleben Pyrokohle | Das Innere eines Biokohlenstücks besteht im Wesentlichen aus aromatischen Kohlenstoffverbindungen, die eine starre Struktur haben und nur schwer abbaubar sind. Verschiedene Strukturen wurden bisher angenommen, in denen der Großteil des inneren „Kerns“ aus kondensierten Benzen-Ringen oder aus konjugierten heterozyklischen Verbindungen wie Furan besteht (Falco et al. 2011b, Titirici et al. 2008).
Zugriffe - 1606
|
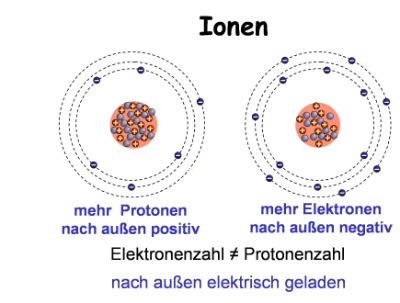
| Ionen |
Zugriffe - 1641
|
| Ionengitter | Unter einem Ionengitter oder Ionenkristall versteht man in der Chemie und der Festkörperphysik die regelmäßige räumliche Anordnung von Anionen und Kationen in einem homogenen Stoff im festen Zustand. Der Zusammenhalt des Gitterverbandes erfolgt durch Ionenbindungen. Ionenkristalle sind die bekanntesten Beispiele für Kristalle mit kubischer Gitterstruktur:
Zugriffe - 1602
|
| Ionische Verbindungen | Ionische Verbindungen[Bearbeiten | Quelltext bearbeiten]
Ionische Verbindungen (Salze) bestehen aus Kationen und Anionen. Sie sind oft salzartig:
Die Ionen entstehen bei der Reaktion von Metall- und Nichtmetallatomen dadurch, dass die Metallatome Elektronen abgeben (Oxidation), die dann von den Nichtmetallatomen aufgenommen werden (Reduktion). Die so gebildeten Metall-Kationen und Nichtmetall-Anionen vereinigen sich auf Grund der elektrischen Anziehungskräfte zu Ionenkristallen. Nach den Nichtmetallen unterscheidet man bei ionischen Verbindungen zum Beispiel Oxide (Sauerstoff als Anion), Sulfide (mit Schwefel), Fluoride, Chloride, Bromide, Iodide, Nitride (mit Stickstoff), Carbide (mit Kohlenstoff), Hydride (mit Wasserstoff) usw. Oft kommt Sauerstoff als drittes Element hinzu; man spricht dann von Sulfaten, Chloraten, Nitraten, Carbonaten usw. Beispiele für Ionenverbindungen sind Eisen(III)-oxid (dem Rost ähnlich), Pyrit (Eisensulfid), Natriumchlorid (Kochsalz) und Calciumsulfat (Gips).
Zugriffe - 1577
|