| Polar/Unpolar |
Polarität bezeichnet in der Chemie die Bildung getrennter Ladungsschwerpunkte in Atomgruppen aufgrund von Ladungsverschiebungen; dadurch sind die Atomgruppen nicht mehr elektrisch neutral.
Das elektrische Dipolmoment ist ein Maß für die Polarität eines Moleküls und bestimmt die Löslichkeit eines Stoffs oder seine Fähigkeit, als Lösungsmittel zu wirken:
- Polare Stoffe sind in der Regel in polaren Lösungsmitteln gut löslich, in unpolaren aber schlecht. Beispiel: Wasser + Salz
- Umgekehrt sind unpolare Stoffe in unpolaren Lösungsmitteln (z. B. in Hexan) oder anderen flüssigen Kohlenwasserstoffen („Benzin“) gut, in polaren aber schlecht löslich.
- Unpolare Stoffe: Benzin, Tetrachlormethan, Wachs, Fett, Alkane, Alkene, Alkine
Ein Lehrsatz der mittelalterlichen Alchemie war: „Similia similibus solvuntur“ (lat.: „Ähnliches löst sich in Ähnlichem“).
Aufgrund ihrer Ionenstruktur sind viele Salze im polaren Lösungsmittel Wasser gut löslich, unpolare Stoffe wie Fette oder Wachse dagegen nicht. Auch viele Aroma- und Duftstoffe sind in Wasser nicht, in Öl oder in Ethanol aber gut löslich. Alkohol ist daher in vielen fettarmen Lebensmitteln als Zutat aufgeführt.
| Polare Moleküle haben in sich ein Ungleichgewicht, was die Verteilung der Bindungselektronen betrifft. Das Atom mit der größeren Elektronegativität zieht die Bindungselektronen stärker an sich. Es entsteht dort der negative Pol. Am gegenüberliegenden Ende befindet sich dann der positive Pol. Man spricht von einer polaren Atombindung. |
| Wichtigstes Beispiel: Das Wassermolekül |
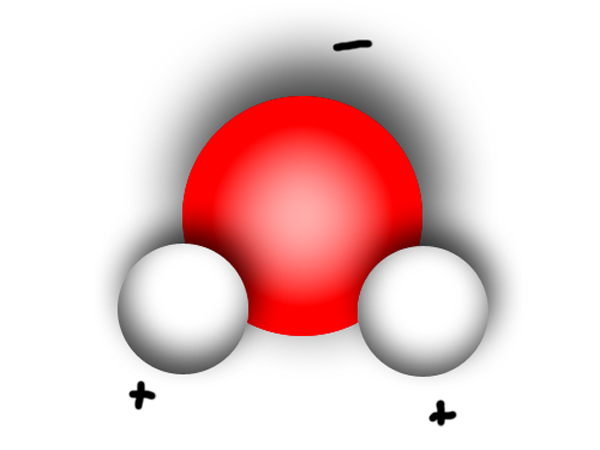 |
| Andere polare Stoffe: Stoffe mit einer OH-Gruppe (= Hydroxyl-Gruppe), Stoffe mit einer COOH-Gruppe (= Carboxyl-Gruppe), Stoffe mit einer NH2-Gruppe (=Aminogruppe). |
| Da sich diese Stoffe sehr gut in Wasser lösen lassen, nennt man sie hydrophil. |
| |
| Unpolare Moleküle enthalten Elemente mit annähernd gleicher Elektronegativität, es kommt in der Bindung zu keiner wesentlichen Verschiebung von Elektronen. |
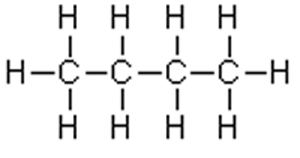 |
| In derartigen Kohlenwasserstoffketten gibt es keine Polarität. Unpolare Stoffe lassen sich in unpolaren Lösungsmitteln lösen. Wasser gegenüber reagieren sie abweisend, also hydrophob. |
| Hierher gehören Öle, Fette, Alkane. |
| Nun gibt es aber auch Stoffe mit einem hydrophilen Anteil und einem hydrophoben Anteil, wie zum Beispiel Ethanol (Alkohol). |
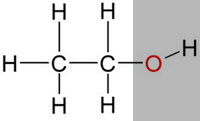 |
| Daher ist Ethanol gut in Wasser löslich, kann aber auch Fett lösen. |
| |
Zugriffe - 1745
|



